Kyrmiah,全球第一款被FDA核准的 CAR-T 疗法。Kyrmiah由诺华(Novartis)研发,用于治疗抗药性/复发型前体 B 细胞急性淋巴性白血病(refractory / relapse B-cell precursors acute lymphoblastic leukemia,r/r B-cell ALL)且 25 岁以下的病患,其嵌合型抗原受体(chimeric antigen receptor)为靶向CD19 蛋白,并包含 4-1BB 的共刺激区域来增强嵌合型抗原受体的表达量与持续性。
Kyrmiah最开始是由美国宾夕法尼亚大学开发,而Novartis于2012 年 8 月取得其全球商品化开发的权利。因为Kyrmiah具有孤儿药(Orphan designation)、突破性疗法(breakthrough designation)、优先审查(priority review)等资格,从送件至获准仅不到 7 个月,最终在2017 年8 月30 日拿到FDA的批准书。
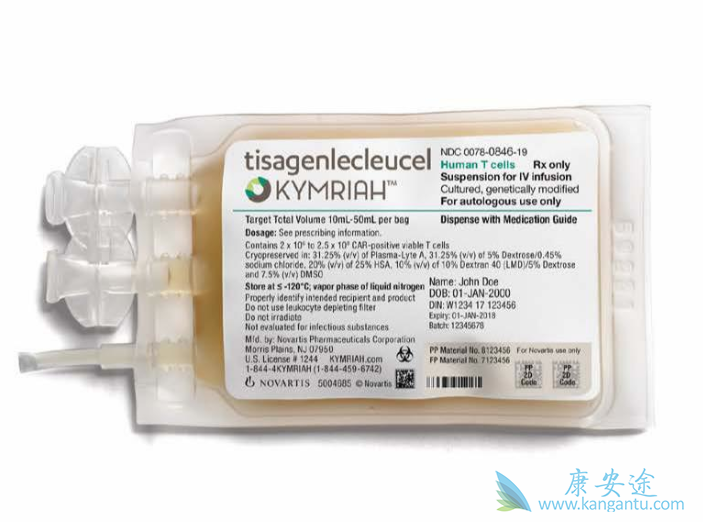
CAR-T细胞疗法Kyrmiah临床试验设计为多国多中心,临床试验点包含美国、欧盟、加拿大、澳洲、日本等11 个国家,共有68名受试者参与。结果显示整体缓解率(overall remission rate,ORR)为 83%,6 个月内无复发的比例为75% ,而整体存活期(overall survival,OS)达 6 个月者占 89%、12 个月者占 79%。良好的疗效也让Novartis 在Kyrmiah价格上拥有高议价能力,每次治疗475,000 美元的定价,较干细胞移植(350,000~800,000 美元)而言还是比较合理的,特别是CAR-T 疗法成本原本就相当高昂。
需要强调的是,r/r B-cell ALL在市场上有高度的需求性。急性淋巴性白血病(acute lymphoblastic leukemia,ALL)在美国每年约有 5,000 名被诊断发生率,其中约 60% 的病患为 20 岁之下、80%~85% 属于 B 细胞子型。ALL 经干细胞移植治疗后复发的两年存活率仅约 15%,是儿童/青少年因癌症死亡的主要因素。对于复发型ALL患者,CAR-T将是最后一搏。
更多新闻请您访问 肿瘤 https://www.kangantu.com/









请简单描述您的疾病情况,我们会有专业的医学博士免费为您解答问题(24小时内进行电话回访)