不久将来,赛诺菲或将加入快速增长的PD-1/PD-L1抑制剂市场,FDA为该公司皮肤癌药物Cemiplimab设定了审评截止日期,为今年的10月28日。美国FDA授予了PD-1靶向药物Cemiplimab优先审评资格,因为该药物的首个适应证,即皮肤鳞状细胞癌(CSCC)是继基底细胞癌之后第二大最常见形式皮肤癌,也是继黑色素瘤后最致命的一种皮肤癌,目前尚无获得批准的药物。Cemiplimab由赛诺菲与再生元合作开发,它是新一波检查点抑制剂中首个申请用于CSCC的药物,该药物去年9月份还获得了FDA的突破性疗法资格。Cemiplimab在欧洲的上市申请已于今年4月份提交,有望明年初获准上市。
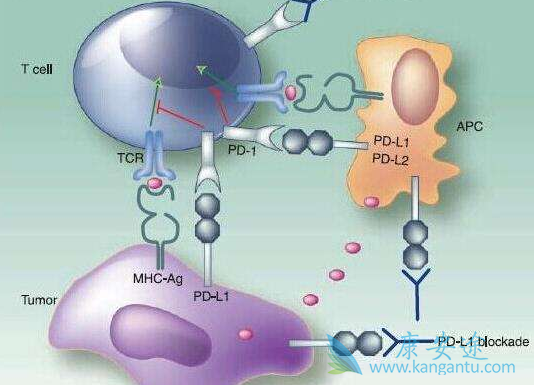
目前市场上已经有5个PD-1或PD-L1靶向药物上市,赛诺菲与再生元的这款药物属于后来者。不过,选择CSCC作为上市申请的首个适应证将会让该药物在与其它药物,如百时美施贵宝的纳武单抗和默沙东的派姆单抗头对头竞争之前建立起一种优势。也就是说,Cemiplimab可能用不了多久就会拥有其自己的市场。派姆单抗正进行皮肤鳞状细胞癌的2期临床试验,该药物丰富的临床经验将使其成为一个强劲的竞争对手,即使赛诺菲与再生元占有先发优势。此前,由于糖尿病重磅药物来得时(甘精胰岛素)专利保护到期及登革热疫苗Dengvaxia投放市场后开局不顺,赛诺菲便进入一个艰难期,该公司正指望一系列新的药物来扭转这一颓势,Cemiplimab正是其中之一。









请简单描述您的疾病情况,我们会有专业的医学博士免费为您解答问题(24小时内进行电话回访)